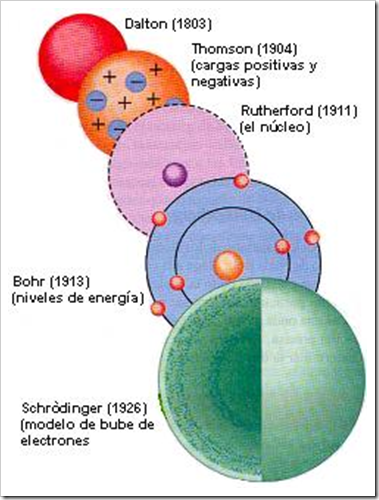
Los químicos utilizan las formulas químicas para expresar la composición de las moléculas y los compuestos iónicos, por medio de los símbolos químicos. Composición significa no solamente los elementos presentes, sino también la proporción en la cual se combinan los átomos. Es necesario familiarizarse con dos tipos de fórmulas: fórmulas moleculares y fórmulas empíricas.
Fórmulas moleculares
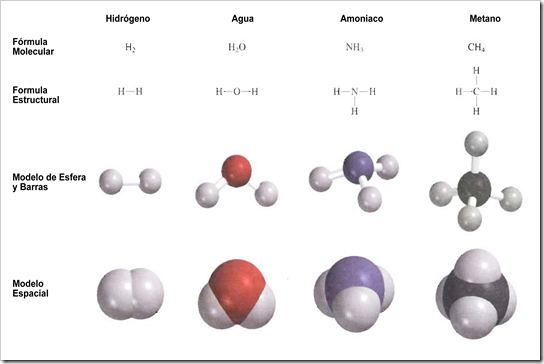
Una fórmula molecular indica el número exacto de átomos de cada elemento que están presentes en la unidad más pequeña de una sustancia. En el análisis sobre moléculas, cada ejemplo se presenta con su fórmula molecular entre paréntesis. Así el H2 es la fórmula molecular del hidrógeno, O2 representa al oxígeno, O3 es el ozono y H2O representa al agua. El subíndice numérico indica el número de átomos de cada elemento que están presentes. En el caso del H2O no aparece un subíndice para el O debido a que solamente hay un átomo de oxígeno en una molécula de agua; de esta manera se omite el subíndice "uno" de las formulas. Observe que oxígeno (O2) y ozono (O3) son alótropos del oxígeno. Un alótropo es una de dos o más formas diferentes de un elemento. Dos formas alotrópicas del elemento carbono -diamante y grafito-, son completamente diferentes no sólo en sus propiedades químicas, sino también en su costo relativo.
Modelos moleculares
Las moléculas son demasiado pequeñas como para poder observarlas de manera directa. Una forma efectiva para visualizarlas es mediante el uso de modelos moleculares. Por lo común se utilizan dos tipos de modelos moleculares: los modelos de esferas y barras, y los modelos espaciales. En los modelos de esferas y barras los átomos están representados por esferas de madera o de plástico con orificios perforados en ellas. Para representar los enlaces químicos se utilizan barras o resortes. Los ángulos que se forman entre los átomos en los modelos se aproximan a los ángulos de enlace reales de las moléculas. Con excepción del átomo de H, todas las esferas son del mismo tamaño y cada tipo de átomo está representado por un color específico. En los modelos espaciales los átomos están representados por esferas truncadas que se mantienen unidas a presión de tal manera que los enlaces no se ven. El tamaño de las esferas es proporcional al tamaño de los átomos, El primer paso para construir un modelo molecular consiste en escribir la formula estructural, que muestra cómo están unidos entre sí los átomos de una molécula. Por ejemplo, se sabe que en la molécula de agua cada uno de los átomos de H esta unido a un átomo de O. Por tanto, la fórmula estructural del Agua es H-O-H.
Una línea que une dos símbolos atómicos representa un enlace químico.
Los modelos de esferas y barras muestran con claridad la distribución tridimensional de los átomos y son relativamente fáciles de construir. Sin embargo, el tamaño de las esferas no es proporcional al tamaño de los átomos. Como consecuencia, las barras por lo general exageran la distancia entre los átomos de una molécula. Los modelos espaciales son más exactos porque muestran la diferencia del tamaño de los átomos. El inconveniente es que su construcción requiere de más tiempo y no muestran bien la posición tridimensional de los átomos.
Fórmulas empíricas
La fórmula molecular del peróxido de hidrógeno, sustancia que se utiliza como antiséptico y como agente blanqueador para fibras textiles y decolorante del cabello, es H2O2 Esta fórmula indica que cada molécula de peróxido de hidrógeno contiene dos átomos de hidrógeno y dos átomos de oxígeno. La relación de átomos de hidrógeno a átomos de oxígeno en esta molécula es 2 : 2 o 1 : 1. La fórmula empírica de peróxido de hidrógeno es HO. En consecuencia, la fórmula empírica indica cuáles elementos están presentes y la relación mínima, en número entero, entre sus átomos, pero no necesariamente indica el número real de átomos en una molécula determinada. Como otro ejemplo, considere el compuesto hidrazina (N2H4), que se utiliza como combustible para cohetes. La fórmula empírica de la hidrazina es NH2 La relación entre el nitrógeno y el hidrógeno es 1 : 2, tanto en la fórmula molecular (N2H4) como en la fórmula empírica (NH2); sólo la fórmula molecular indica el número real de átomos de N (dos) y de H(cuatro) presentes en una molécula de hidrazina.
I.as fórmulas empíricas son las fórmulas químicas más sencillas', se escriben de manera, que los subíndices de las fórmulas moleculares se reduzcan a los números enteros más pequeños que sea posible. Las fórmulas moleculares son las fórmulas verdaderas de las moléculas. su fórmula empírica.
Para muchas moléculas, la formula molecular y la fórmula empírica son la misma.
Algunos ejemplos lo constituyen el agua (H2O), el amoniaco (NH3), el dióxido de carbono (CO2) y el metano (CH4).